工学院熊春阳团队与合作者发现阻断力敏感通道piezo1增强t细胞肿瘤杀伤效能
越来越多的研究表明,机械力是机体生长发育、结构重建以及功能维持的重要因素,也与疾病的发生发展密切相关。力生物学(mechano-biology)研究对深入理解生命运行规律,解释生理病理现象有重要意义。例如美国科学家ardem patapoutian教授就因为发现力敏感通道-piezo获得2021年度诺贝尔奖。力学与生物医学的深度交叉融合,涌现出像机械力肿瘤学(mechano-oncology)、机械力免疫学(mechano-immunology)等新概念、新方向。
免疫治疗作为新一代肿瘤治疗方法,具有巨大的临床应用前景。t细胞是肿瘤免疫治疗的关键细胞,可通过分泌穿孔素和颗粒酶等发挥杀伤肿瘤的作用。然而,t细胞这一功能受到肿瘤微环境中多种因素抑制,导致临床上仅有少数患者能够从免疫治疗中获益。因此,为了增强肿瘤免疫治疗效果,研究t细胞肿瘤杀伤调控新机制,发现新靶点十分必要;而力学是否参与调控t细胞肿瘤杀伤,也是机械力免疫学的一个前沿课题。
2024年3月21日,工学院熊春阳教授团队联合中国医学科学院基础医学研究所刘玉英研究员团队在nature biomedical engineering(《自然生物医学工程》)发表了题为《piezo1机械调控t细胞肿瘤杀伤效能》()的论文,发现阻断力敏感通道piezo1会增强t细胞牵引力,进而加强其对肿瘤的杀伤效能。
研究团队发现,抑制或敲低piezo1有效增强t细胞杀灭肿瘤细胞;并且不依赖于细胞因子的分泌以及颗粒酶b、穿孔素的产生,提示piezo1可能以非经典方式调节t细胞杀伤功能。

图1. piezo1阻断增强t细胞牵引力及肿瘤杀伤效能。a) t细胞牵引力检测示意图。b) 小分子药物阻断piezo1增强t细胞牵引力。c, d)小分子药物阻断(c)和shrna(d)敲减piezo1增强t细胞的肿瘤杀伤效果
已有研究发现t细胞可通过免疫突触对靶细胞施加机械力,进而增强穿孔素的成孔活性来增强靶细胞的杀伤(cell 2016)。因此,研究团队利用之前建立的精确表征细胞力的技术-牵引力显微镜(traction force microscopy)来测量t细胞的牵引力,发现抑制或敲低piezo1都会增强cd8 t细胞的牵引力(图1),而细胞松弛素d破坏牵引力的形成,同时也降低t细胞的杀伤功能,提示牵引力调控t细胞的肿瘤杀伤功能。
研究团队随后给荷瘤小鼠注射piezo1拮抗剂(gsmtx4)预处理的细胞毒性t细胞,发现更多的t细胞浸润到肿瘤部位,抑制肿瘤生长;而piezo1拮抗剂与抗pd-1抗体联合使用,取得更好的疗效,提示piezo1具有与传统免疫检查点阻断疗法类似的免疫治疗效果。
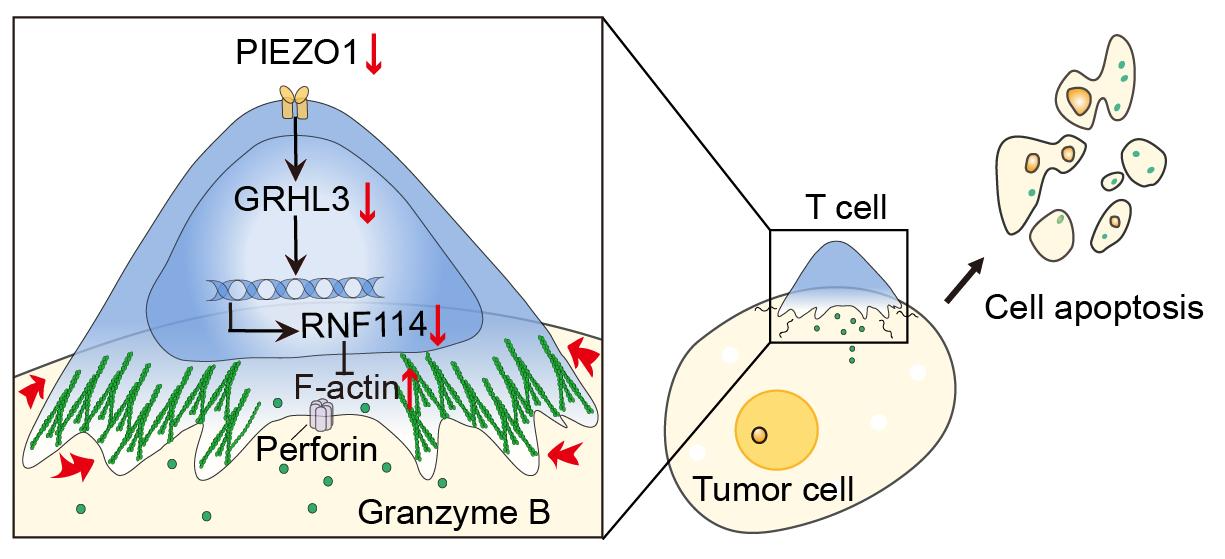
图2. piezo1-grhl3-rnf114信号通路调控t细胞肿瘤杀伤的力学生物学机制
那么,piezo1是如何调控t细胞牵引力,进而影响其杀伤功能呢?通过转录组测序分析,研究团队发现piezo1-grhl3-rnf114信号通路调控骨架蛋白f-actin的重塑,进而影响t细胞牵引力,导致其杀伤功能改变(图2)。这一机理在临床肿瘤患者样本中得到进一步验证,有意义的是grhl3或rnf114表达水平与肿瘤患者cd8 t细胞浸润程度以及免疫治疗效果负相关。
总之,该研究发现力敏感通道piezo1可以作为“生物力学免疫检查点”调控肿瘤免疫功能,这为实现基于生物力学原理的免疫调控,增强传统免疫治疗效果提供了新思路;此外,牵引力显微镜作为一种免标记、实时动态、高灵敏细胞力学检测技术,可望在疾病分型、疗效评价、药物筛选等方面发挥更大的作用。
中国医学科学院基础医学研究所研究生庞瑞洋(现北京大学工学院博士生)与温达瀚、北京大学博士生孙伟皓、北京协和医院杨莹韵副研究员以及国科温州研究院林峰副研究员为论文的共同第一作者。熊春阳与刘玉英、梁俊波副研究员为论文共同通讯作者。
转载本网文章请注明出处