化学学院陈鹏/樊新元团队报道用于原代生物样品研究的生物正交光催化邻近标记技术cat-s
细胞的生命活动受到各个亚细胞器(细胞核、线粒体、内质网等)中蛋白质网络的精细调控,以保证其有条不紊地进行。任一亚细胞区域中蛋白质“零件”的损坏或失调,就有可能“牵一发而动全身”,造成细胞的异常乃至疾病的发生。因此,研究亚细胞区域的蛋白质组,尤其是针对临床疾病相关的样品,一直以来是蛋白质组学研究的热点。近年来,邻近标记(proximity labeling)技术的发展,突破了传统亚细胞器分离方法的局限,使得在活细胞中原位研究特定亚细胞蛋白质组成为可能。然而,基于生物催化的邻近标记技术往往需要对细胞进行基因改造以在胞内引入邻近标记酶(如apex、bioid等),使其不适宜在难以基因改造的样品(尤其是原代细胞、临床样品)中运用。如何开发适用于原代活细胞及组织样品的邻近标记技术,成为该领域亟需攻克的挑战。

文章截图
近期,以小分子光催化邻近标记为代表的化学生物学方法的出现展现出了用于难转染样品研究的巨大潜力。如诺奖得主macmillan课题组联合默克研究人员开发了基于光催化产生活性卡宾探针的细胞膜蛋白质邻近标记技术μmap1,并在此基础上持续探索这类新型技术的应用范围2。北京大学化学与分子工程学院陈鹏教授/樊新元团队基于光催化产生活性亚甲基醌探针开发细胞内线粒体蛋白质邻近标记技术cat-prox3、细胞膜受体靶向的cat-ex技术4、细胞互作邻近标记的cat-cell5等技术。在国内外研究者的共同推动下,光催化邻近标记的研究取得了蓬勃发展,很多创新技术相继涌现,为蛋白质组学研究提供了全新的化学工具。
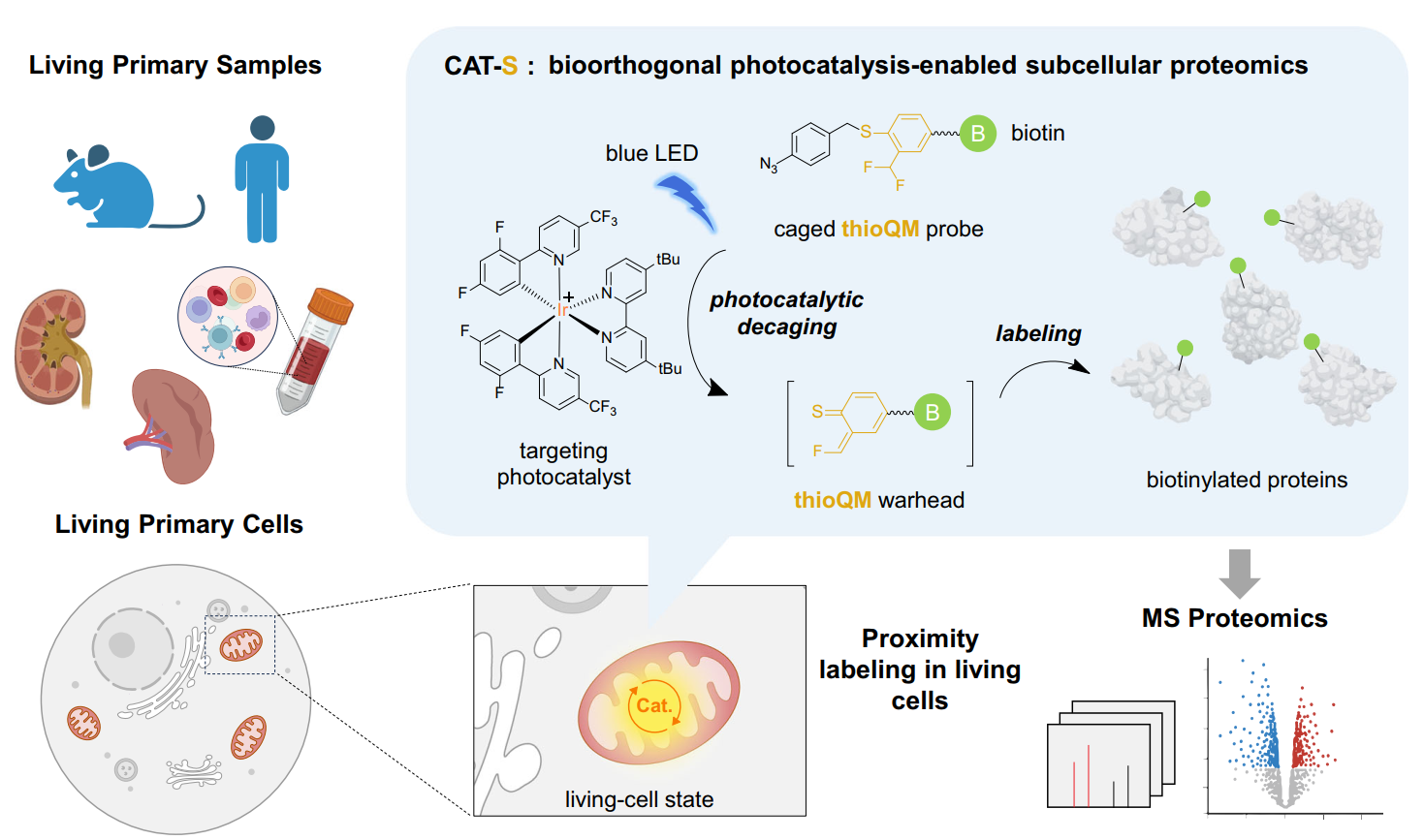
cat-s技术概览。新型s代亚甲基醌探针具有更好的标记效率
然而,组织原代、甚至人体临床等更为复杂样品的原位标记由于存在技术瓶颈而一直处于空白。3月28日,陈鹏/樊新元团队在nature communications杂志发表了题为“”的研究论文。他们在前期开发的线粒体靶向的光催化邻近标记技术cat-prox的基础上,通过化学改造开发出新一代具有更高标记活性的硫代亚甲基醌探针,以适应更为复杂的原代组织的生物样品,从而实现了组织原代、甚至人体临床样品的线粒体蛋白质的原位标记(cat-s技术)6。
作者基于前期的cat-prox技术进行系统性优化和升级,特别是针对传统常用的亚甲基醌(qm)标记探针进行化学改造,通过引入硫原子开发出新一代硫代qm标记基团(thioqm),在体外及活细胞内展现出比传统氧代qm显著提升的蛋白质标记效率。他们在多种细胞系中验证了该方法对线粒体蛋白质的高效捕捉:通过与蛋白质谱技术的联用,能够在80%左右的高特异性水平下,定量鉴定300个以上的线粒体蛋白,描绘活细胞线粒体蛋白质组特征;通过综合分析在多种细胞系中获取的数据,进一步发掘并验证了ptpn1、slc35a4 uorf及trabd三个新的线粒体定位蛋白,展现该技术在发现新的线粒体蛋白方面的能力。
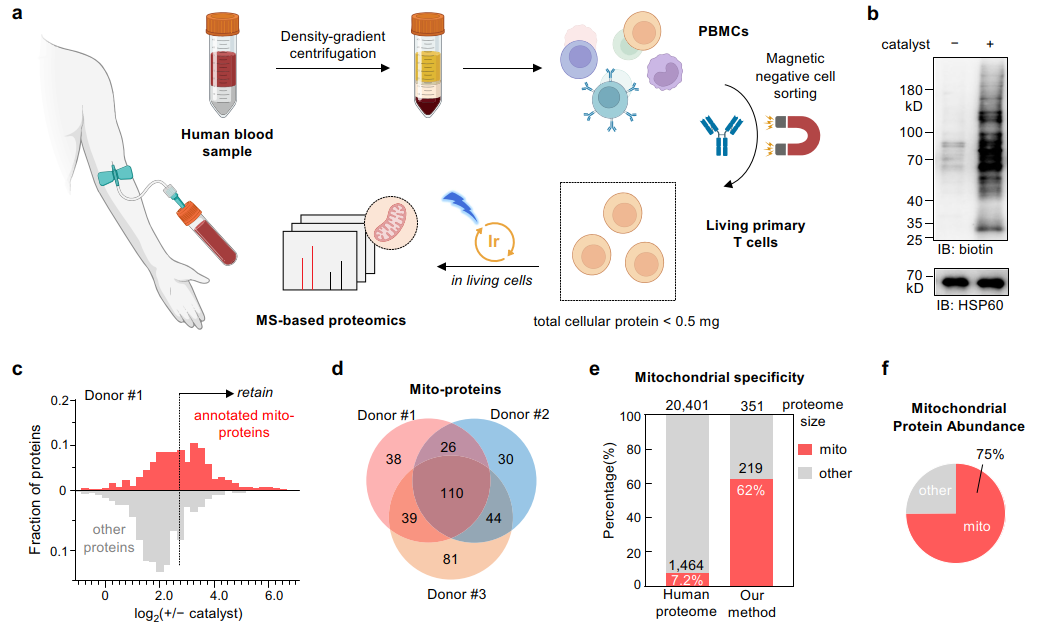
cat-s技术用于临床样品亚细胞分辨的蛋白质组原位解析
原代活细胞样品(尤其是临床样品)上的应用一直是邻近标记领域的难点。对此,研究者通过cat-s技术实现了对小鼠肾脏、脾脏的解离细胞样品中线粒体蛋白的邻近标记捕捉,避免了酶法邻近标记技术对转基因动物模型的依赖。据此,研究者定量比较了肥胖诱导ii型糖尿病小鼠和健康小鼠中的肾脏线粒体蛋白质组特征,发现一系列在疾病状态下表达变化的线粒体蛋白。其中,脂代谢相关酶类的变化较为显著,其中aldh3a2、acsm2的下降可能造成了相关脂质代谢物的累积,潜在地促进了糖尿病相关的肾病发展。此外,研究者还证明了cat-s技术能够对人血液样品中原代t细胞进行原位线粒体蛋白标记,展现了在临床样品上的应用潜力。
综上,该工作对生物正交光催化标记化学进一步发展,实现了其在动物组织和临床来源的原代细胞的应用,并进行了原位线粒体蛋白质组解析。其无需基因改造、通用性、光控时空分辨等特点,为原代样品的亚细胞蛋白质组学研究开辟了新途径。基于该策略,进一步发展靶向其他亚细胞区域的生物正交标记方法、探究更多疾病相关的组学信息,将是未来值得期待的方向。
樊新元、陈鹏为本文的通讯作者,博士后刘子琦与博士研究生郭福虎为本文的共同第一作者。该工作得到来自国家自然科学基金、科技部重点研发计划、北京市自然科学基金、李革-赵宁生命科学青年研究基金等项目经费的支持。
参考文献:
1. geri, j. b.; oakley, j. v.; reyes-robles, t.; wang, t.; mccarver, s. j.; white, c. h.; rodriguez-rivera, f. p.; parker, d. l.; hett, e. c.; fadeyi, o. o.; oslund, r. c.; macmillan, d. w. c., microenvironment mapping via dexter energy transfer on immune cells. science 2020,367 (6482), 1091.
2. seath, c. p.; burton, a. j.; sun, x.; lee, g.; kleiner, r. e.; macmillan, d. w. c.; muir, t. w., tracking chromatin state changes using nanoscale photo-proximity labelling. nature 2023,616 (7957), 574—580.
3. huang, z.; liu, z.; xie, x.; zeng, r.; chen, z.; kong, l.; fan, x.; chen, p. r., bioorthogonal photocatalytic decaging-enabled mitochondrial proteomics. j. am. chem. soc. 2021,143 (44), 18714—18720.
4. liu, z.; xie, x.; huang, z.; lin, f.; liu, s.; chen, z.; qin, s.; fan, x.; chen, p. r., spatially resolved cell tagging and surfaceome labeling via targeted photocatalytic decaging. chem 2022,8 (8), 2179—2191.
5. zhang, y.; liu, s.; guo, f.; qin, s.; zhou, n.; fan, x.; chen, p. r., bioorthogonal photocatalytic quinone methide decaging for cell-cell interaction labeling. biorxiv 2023, 2023.04. 08.536099.
6. liu, z.; guo, f.; zhu, y.; qin, s.; hou, y.; guo, h.; lin, f.; chen, p. r.; fan, x., bioorthogonal photocatalytic proximity labeling in primary living samples. nat. commun. 2024,15 (1), 2712.
转载本网文章请注明出处