化学学院雷晓光团队与合作者阐明离子通道蛋白trpv4小分子抑制剂的结构药理学基础
瞬时感受器电位香草酸受体4(transient receptor potential vanilloid 4,trpv4)是瞬时受体电位离子通道家族的成员之一,属于非选择性阳离子通道。trpv4广泛分布于大脑、心脏、肝脏、肺部、肾脏、胰腺、卵巢、骨组织以及皮肤表面,可以被机械刺激、低渗透压、温度等理化刺激激活。trpv4在调节大脑对系统渗透压的功能中发挥作用,参与血管功能、肝脏、肠道、肾脏和膀胱功能、皮肤屏障功能、骨骼的生长和结构完整性、关节功能、气道和肺功能、视网膜和内耳功能,以及疼痛等多个方面。trpv4基因突变与骨发育不良、早期骨关节炎和神经运动功能障碍等多种遗传性疾病相关,例如为人熟悉的苏格兰折耳猫中发生的trpv4突变,表现为遗传性的苏格兰折耳猫软骨发育不良综合征(scottish fold osteochondrodysplasia,sfocd)。sfocd影响前肢远端、后肢远端和尾部的形态,导致软骨纤维化和关节逐渐受损。
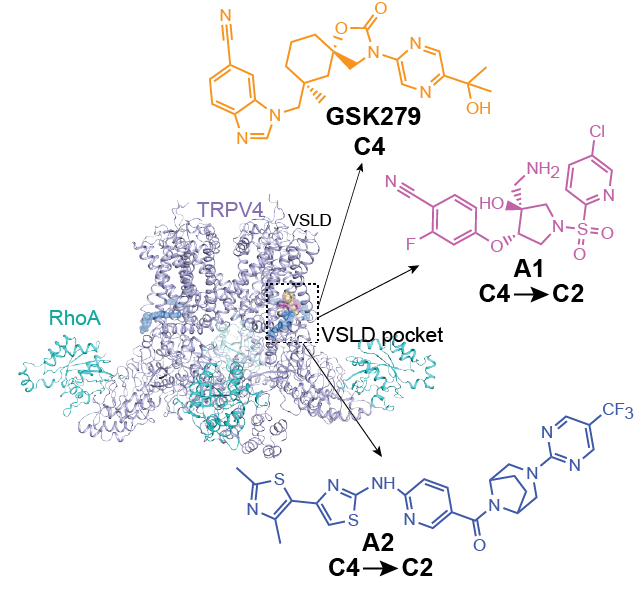
动物研究结果表明,trpv4拮抗剂在水肿、疼痛、胃肠道疾病和肺部疾病(如咳嗽、支气管收缩、肺动脉高压和急性肺损伤)方面具有治疗潜力。因此,开发trpv4的拮抗剂具有较大的临床价值。目前有多家国际知名制药企业如:bayer、gsk都在积极地针对trpv4开发小分子候选药物,并且推进到人体临床试验一期、二期。然而截止目前,人们对trpv4拮抗机制的分子机制仍然知之甚少。在该研究中,北大化学与分子工程学院雷晓光教授团队解析了人源trpv4与两种高亲和力拮抗剂复合物的冷冻电子显微镜结构,揭示了trpv4的详细结合口袋和调节机制。研究发现两种拮抗剂均与电压感应样结构域(vsld)结合,并稳定通道处于闭合状态。需要特别指出的是,这两种拮抗剂使trpv4明显从四重对称过渡到二重对称,而其中拮抗剂a1的结合使得trpv4发生了较大的挤压变形,此现象在其他trpv家族成员中有报道,但在trpv4中是首次被发现。并且团队还发现拮抗剂a2与传统的vsld口袋不同,相对于a1,其结合位置明显靠近蛋白外侧,被称为vsld的扩展口袋。结合电生理实验和分子动力学模拟结果,该研究提供了关于小分子拮抗剂调节trpv4的关键机制见解,有助于未来针对trpv4的创新药物开发。该工作是雷晓光课题组前期发表的同家族离子通道蛋白trpv3工作之后(nature chemical biology 2023, 19, 81—90),在靶向离子通道蛋白的结构药理学和新药开发方向上做出的又一重要科研成果。该工作以为题发表在国际期刊advanced science上。
原理图
雷晓光、北京大学医学部药学院黄卓教授以及雷晓光团队副研究员范俊萍博士是论文的共同通讯作者。北京大学化学与分子工程学院范俊萍博士、北京大学医学部药学院郭畅博士为该文共同第一作者。阳光安津生物医药公司的廖道红博士、雷晓光课题组博士研究生柯翰、谢文军、博士后唐毓良,以及日本国立生理科学研究所的富勇真琴(makoto tominaga)教授和其课题组的雷晶博士为该研究中作出了重要贡献。该研究得到了国家重点研发计划、国家自然科学基金、北京分子科学国家研究中心、北大-清华生命科学联合研究中心、新基石基金会等项目和单位的资助,相关的分子动力学模拟在北京大学高性能计算平台上完成。中科院生物物理所冷冻电镜平台对该研究提供了冷冻电镜支持。
转载本网文章请注明出处