生命科学学院jackson champer课题组在黑腹果蝇中鉴定到多个有着基因驱动高性能的生殖系特异表达启动子
2024年5月29日,北京大学生命科学学院jackson champer研究员课题组在nature communications上发表题为“”的研究论文。本研究旨在寻找和测试具有优秀驱动性能的cas9启动子,以助力高效基因驱动系统的构建。champer课题组构建并测试了11个不同的生殖系cas9启动子的基因驱动性能。结果表明,一些启动子(如rcd-1r和cg4415)可提高驱动转换率并降低胚胎抗性等位基因形成率。此外,champer课题组选择了3个cas9启动子品系,结合复合表达4个grna的抑制驱动品系,进行了多世代的笼子实验。实验结果显示,cg4415启动子的驱动性能明显优于nanos启动子,消灭了笼子种群。综上所述,这些cas9启动子在构建高效的果蝇归巢基因驱动系统中展现出了极大的优势,同时也为其他物种的相关研究提供了重要参照。

论文截图
基因驱动(gene drive)技术能够使特定的基因型偏向性地遗传给后代,因而在控制害虫种群和减少媒介传播疾病方面具有巨大的应用潜力,是近年来新兴的研究热点。基因驱动可分为种群修饰型驱动(population modification drive)和种群抑制型驱动(population suppression drive)。种群修饰型驱动通过携带载荷基因,使种群内个体获得相应的表达性状,而种群抑制型驱动则可为了健康、生态或经济目的减少或消灭目标害虫种群。
crispr归巢基因驱动是目前研究最广泛的,也可能是最强大的基因驱动系统。在含有驱动等位基因的杂合子中,驱动等位基因在生殖系细胞减数分裂早期表达cas9和grna,靶向切割野生型等位基因,形成双链断裂后,野生型等位基因通过同源重组修复转化为驱动等位基因,这个过程称为“驱动转换(drive conversion)”或“归巢(homing)”。当生殖系细胞从杂合子发生驱动转换为纯合子时,驱动等位基因能够以更高的比例遗传给下一代。然而,并不是所有的双链断裂都会以同源重组的方式修复,若断裂以末端连接的方式进行修复,靶位点突变后会形成抗性等位基因,阻止grna识别。该情况主要发生于胚胎期和体细胞期,由母体沉积的cas9和泄露表达的cas9造成。抗性等位基因的存在可能会严重阻碍基因驱动在种群中传播,甚至导致驱动失败。cas9的特异性表达对于基因驱动十分关键,一个理想的基因驱动cas9启动子应只在减数分裂早期开启表达,在胚胎发育和体细胞阶段关闭,即可在基因驱动系统中达到高驱动转换率、低抗性等位基因形成率和低水平的体细胞表达[1, 2]。已有研究表明,果蝇的nanos启动子能够避免体细胞泄露表达,但母体沉积的cas9仍导致较高的胚胎抗性。
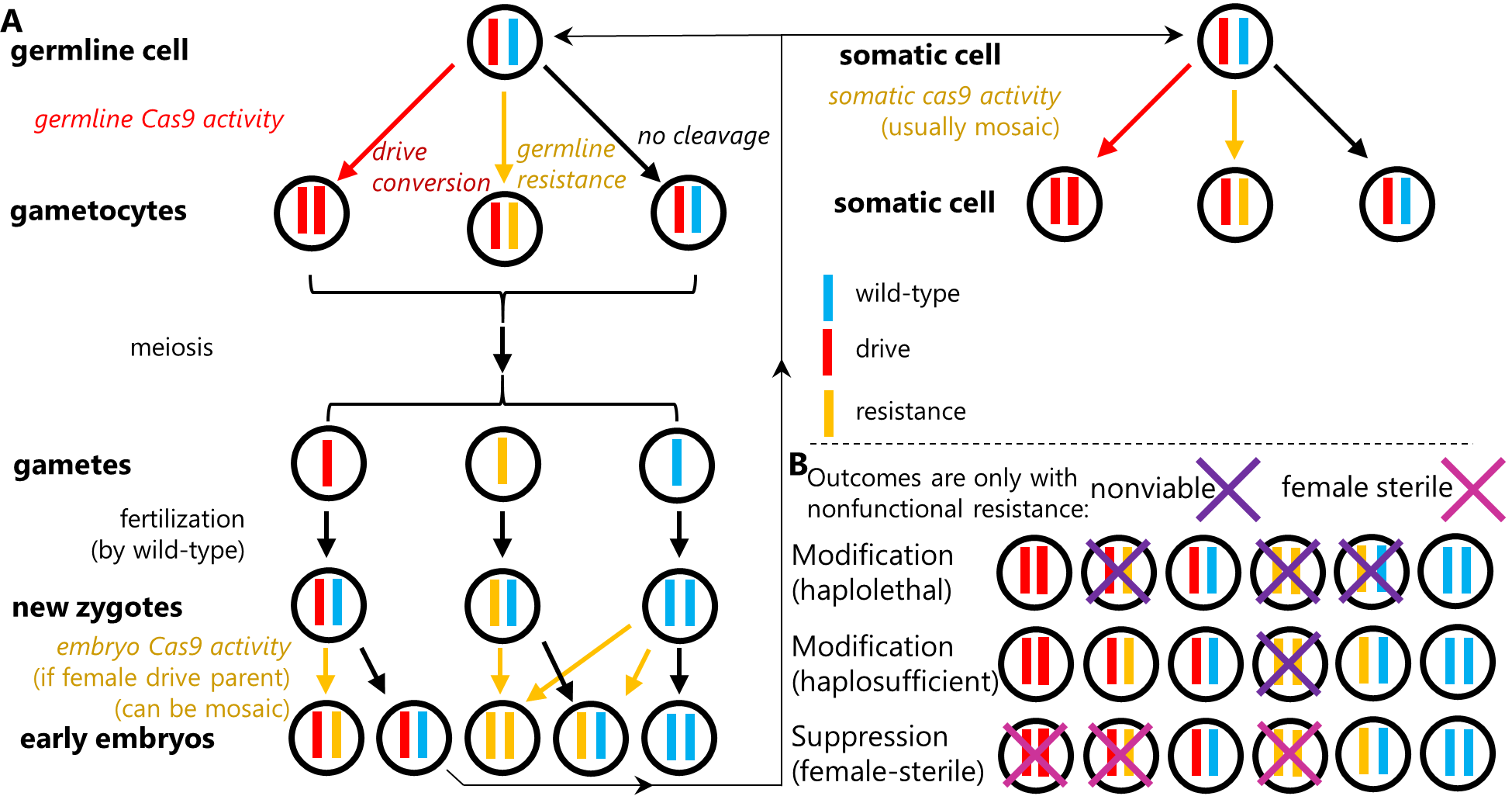
图1 归巢基因驱动中的cas9活性。(a) 驱动转化发生在驱动/野生型杂合子的生殖系细胞中,(b)根据基因驱动的类型,某些个体可能无法存活或者不育
本研究中,champer课题组以前人研究较多的nanos和vasa启动子为基础,根据黑腹果蝇早期胚胎的生殖系限定表达和低mrna水平选择其他启动子,构建了两种类型的驱动系统。其中,合成驱动系统的cas9元件和grna驱动元件位于同一等位基因中,并靶向egfp基因[3]。测试结果表明,大多数启动子在雄性中的驱动遗传率为72—89%,在雌性中为85—95%,其中只有rcd-1r、shu和cg4415启动子展示出明显较低的胚胎抗性等位基因形成率。由于测试品系中的egfp只在果蝇眼部表达,因此该合成驱动系统只能观察cas9/grna在眼部的切割活动,无法评估体细胞和胚胎抗性的发生情况。
在分离驱动中,cas9元件与grna驱动元件位于不连锁的等位基因中,需将两种品系杂交后测试驱动转换效率,便于评估启动子在不同靶标位点和驱动设计中的表现。本研究中,champer课题组分别选择了靶向x染色体连锁的yellow基因的分离驱动元件、靶向单倍致死基因rpl35a基因2-grna驱动元件、靶向雌性生殖关键的单倍充足基因yellow-g的4-grna分离驱动元件来测试驱动效率。其中,靶向yellow基因的分离驱动,比egpf驱动有着更低的胚胎抗性,并且可以评估来自雌性的生殖系抗性遗传。结果显示,3个有着高驱动遗传率的cas9启动子元件可避免高胚胎抗性,分别是rcd-1r、cg4415和shu启动子。而在靶向rpl35a基因的分离驱动中,任何无功能的抗性等位基因都会导致个体不可存活。因此,胚胎抗性是有害的,带有抗性等位基因的个体将会从种群中快速清除。除了带有shu启动子的cas9元件,其他启动子均展示了雄性的高驱动遗传率。相比egfp合成驱动和靶向yellow的分离驱动,靶向yellow-g基因的归巢抑制驱动有着更低的胚胎抗性。除了良好的性能参数,它还有强烈抑制的潜力。相比nanos启动子,已鉴定的启动子的体细胞表达量没有明显降低,但是它们有更低的生殖系表达,可降低适合度代价,其中一些启动子有更低的胚胎抗性。相关实验表明只有cg4415启动子有着较高的卵成活率。
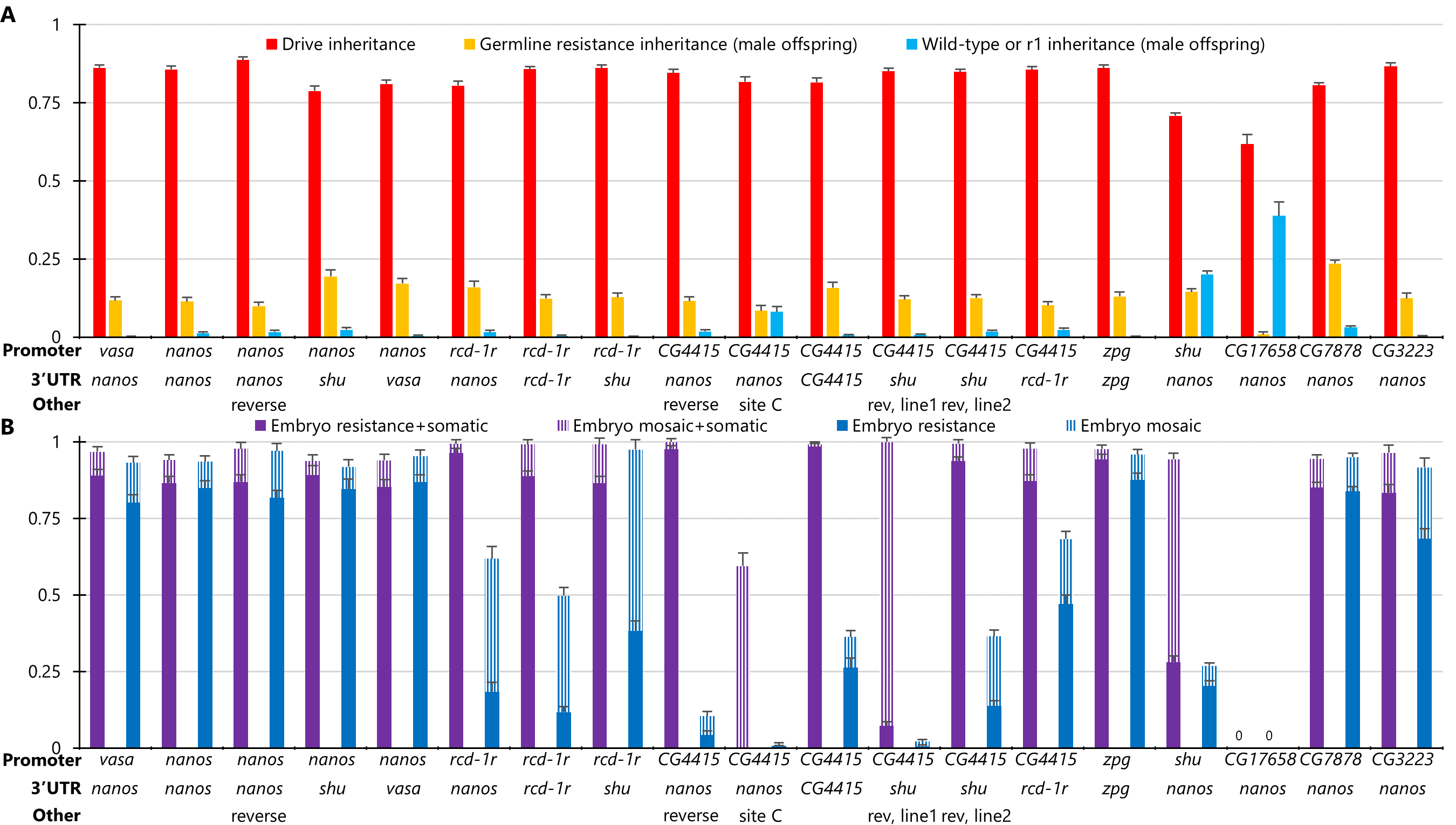
图2 靶向yellow基因的驱动性能
在之前的研究中,champer课题组发现果蝇的nanos启动子,在单管杂交中展示出较少的适合度代价,但在笼子种群中有着明显提高的适合度代价,这可能与nanos启动子的高胚胎抗性有关[4]。本研究中,champer课题组选择了3个cas9品系进行多代笼子实验,其中一个为rcd-1r启动子和shu 3'utr的组合,另外两个为cg4415启动子和nanos 3'utr的组合(其中一个egfp与cas9方向一致,另一个放置于不同的染色体臂中)。在由rcd-1r启动子表达cas9的笼子1中,驱动载体频率缓慢增加,但始终低于27%,仅达到一个较低的平衡值。而由cg4415启动子表达cas9的笼子2,驱动载体频率增加较快,并且笼子种群最终得到抑制。后续实验分别为大部分使用了较干燥的食物和仅使用了新鲜的食物,更为干燥的食物一组(笼子3)仅能达到平衡,新鲜的食物一组(笼子4)支持了笼子2结论。此外,本研究还使用了位于“site c”位点的cg4415-cas9元件分别进行了3次笼子试验(笼子5—7),由于cas9元件带有的雌性杂合子适合度代价较低,驱动载体频率增加并且最终抑制了种群,但是这些笼子的种群规模相对较低。本研究认为,cg4415启动子在笼子中的适合度代价明显低于nanos启动子和rcd-1r启动子。并且与nanos启动子相比,cg4415启动子的胚胎抗性显著降低,这足以抑制大型、强健的果蝇笼子种群。
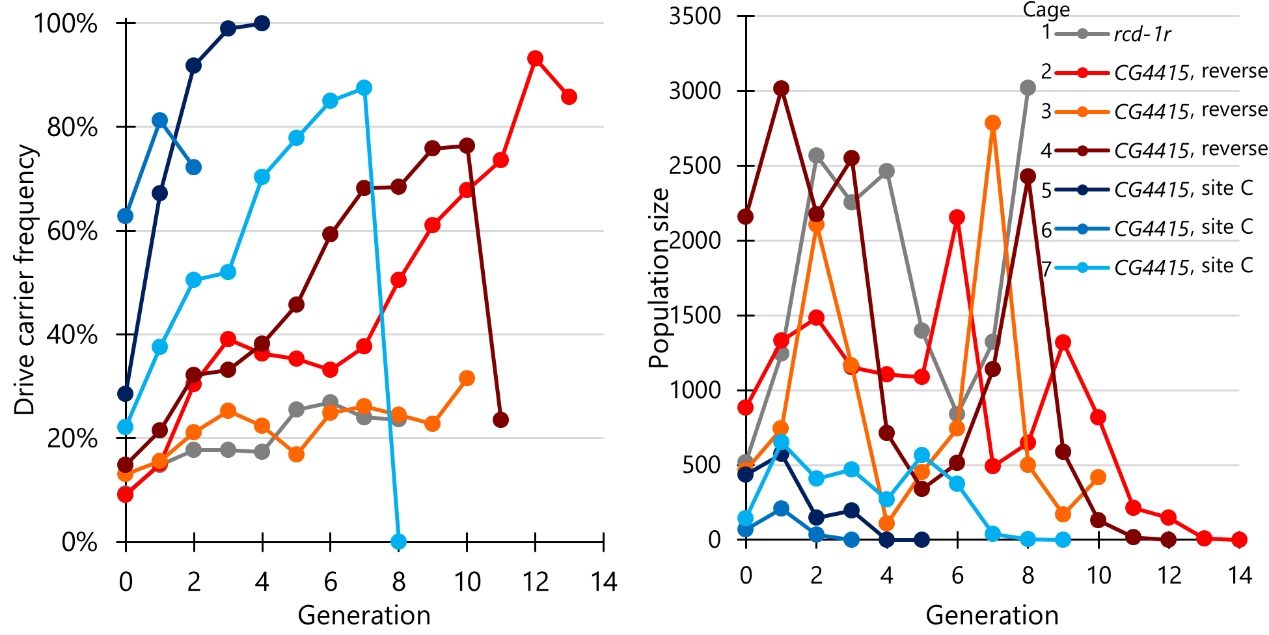
图3 归巢抑制驱动的多世代笼子实验
综上所述,本研究表明,通过组合不同的cas9的启动子、5'utr和3'utr等调控元件,能够有效提高归巢驱动的效率。在不同的驱动系统中,champer课题组鉴定了不同启动子的优势和劣势,以及它们与不同驱动元件的相互作用。这些调控元件为果蝇的驱动系统提供了较大的优势,它们的同源物在其他物种中也可作为有用的潜在候选者。
北京大学生命科学学院博士后杜捷为本论文的第一作者,jackson champer和杜捷为论文的通讯作者。2022级清华大学ptn项目博士生陈为哲、科研助理贾熙华、博士后徐雪娇、实习生周睿知、2021级北京大学生命科学学院本科生张雨琪、康奈尔大学本科生emily yang和matt metzloff,康奈尔大学philipp w. messer助理教授等多位成员对本论文有着重要贡献。该研究得到了北京大学、北大-清华生命科学联合中心、国家自然科学基金、北京大学生命科学学院启东创新基金、美国国立卫生研究院奖等机构和经费的大力支持。
参考文献:
1. champer, j., buchman, a. & akbari, o. s. cheating evolution:engineering gene drives to manipulate the fate of wild populations. nat. rev. genet. 17, 146—159(2016)
2. wang, g.-h. et al. symbionts and gene drive: two strategies tocombat vector-borne disease. trends genet. 37, 708—723 (2022)
3. champer, j. et al. molecular safeguarding of crispr gene driveexperiments. elife 8, e41439(2019)
4. yang, e. et al. a homing suppression gene drive with multiplexedgrnas maintains high drive conversion efficiency and avoidsfunctional resistance alleles. g3 genes|genomes|genetics. 12, jkac081(2022)
转载本网文章请注明出处