生命科学学院郭强课题组与合作者揭示synaptophysin调控突触小泡生成与功能的机制
神经突触小泡是神经系统中负责存储和释放神经递质的关键亚细胞器,通过精确调控神经递质的释放介导信息传递。尽管学界对突触小泡的生化和形态学特性已有一定了解,但关于其关键蛋白如何协同工作以确保神经递质的有效存储和释放,仍有许多未知。
近日,北京大学郭强课题组和斯坦福大学axel t. brunger课题组在nature在线发表了题为的研究论文。该研究首次发现了神经突触小泡膜上的氢离子泵v-atpase与突触素蛋白synaptophysin之间的相互作用,并深入探讨了其对突触小泡生成和功能的影响。
研究者采用了冷冻电子断层扫描(cryo-et)和单颗粒三维重构技术,对小鼠大脑中分离的谷氨酸能突触小泡进行了表征。结果表明,在突触小泡上v-atpase能够与synaptophysin形成1:1化学计量比的稳定复合物,而该复合物在此前分离纯化的样品中未被观察到1—4。为了进一步区分synaptophysin和其同源物,研究者构建了synaptophysin基因敲除小鼠,并解析了其突触小泡上的v-atpase结构,其中电子密度的缺失验证了该蛋白为synaptophysin。高分辨率结构分析揭示了特定曲率膜环境在稳定synaptophysin与v-atpase相互作用中的重要意义,凸显了在天然膜环境中研究蛋白质结构和功能的重要性。
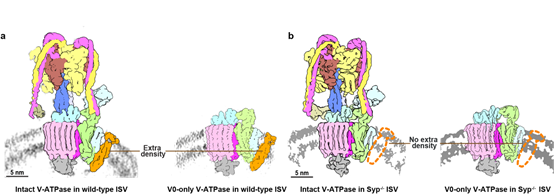
图1 突触小泡上的v-atpase原位结构。使用单颗粒三维重构技术对野生型(a)和synaptophysin基因敲除(b)小鼠突触小泡上的v-atpase进行结构表征
synaptophysin是神经突触小泡表面最丰富的蛋白,是广泛使用的突触小泡标志物,但其生物学功能仍不明确5。synaptophysin基因敲除后,其多种同源物表达量上调并代偿功能,造成其功能研究困难6。本研究中发现synaptophysin基因敲除小鼠在卡因酸诱导的癫痫中表现出高度易感性和更严重的后果。为了研究这一表型的分子机制,研究者利用冷冻电子断层技术统计了野生型和synaptophysin基因敲除型小鼠突触小泡的形态及v-atpase分布特征。尽管两个样品中突触小泡形态相似,synaptophysin基因敲除后,突触小泡上v-atpase的平均拷贝数显著增加。过多的v-atpase拷贝数可能会加剧突触小泡对氢离子的渗透性7,从而影响神经递质的装载,体现为突触小泡功能异常。

图2 synaptophysin基因敲除小鼠表型。a. 突触小泡冷冻电子断层数据及三维渲染。b. 突触小泡v-atpase分布统计。c. 卡因酸诱导的小鼠癫痫实验
基于冷冻电子断层结果的统计分析表明,v-atpase整合到突触小泡是一个随机过程。在野生型突触小泡中,v-atpase与synaptophysin的相互作用会增加复合物的尺寸并限制其对膜曲率的选择性。此外,synaptophysin还可以与synaptobrevin寡聚形成更大的复合物,进一步增加v-atpase相关复合体的尺寸。这些由synaptophysin介导的相互作用会增加突触小泡表面分子的拥挤程度,从而限制v-atpase的随机插入,实现对突触小泡上v-atpase拷贝数的调控。
综上所述,这项研究揭示了神经突触小泡上synaptophysin与v-atpase的相互作用机制,表明synaptophysin通过对突触小泡上v-atpase的数量调控,进而影响突触小泡的生成和功能。本研究综合利用冷冻电子断层技术和单颗粒三维重构技术,在提供高分辨的结构信息的同时获取其拓扑分布特征,为深入研究亚细胞结构和功能调控提供了新的思路和方法。
王楚楚博士、江文宏博士以及jeremy t. s. leitz博士为本论文的共同第一作者。郭强和axel t. brunger为本论文的共同通讯作者。
参考文献:
1. abbas, y.m., wu, d., bueler, s.a., robinson, c.v. & rubinstein, j.l. structure of v-atpase from the mammalian brain. science 367, 1240—1246 (2020).
2. wang, r. et al. cryo-em structures of intact v-atpase from bovine brain. nat commun 11, 3921(2020).
3. wang, l., wu, d., robinson, c.v., wu, h. & fu, t.m. structures of a complete human v-atpase reveal mechanisms of its assembly. mol cell 80, 501—511 e503 (2020).
4. wang, r., qin, y., xie, x.s. & li, x. molecular basis of meak7-mediated human v-atpase regulation. nat commun 13, 3272(2022).
5. jahn, r., schiebler, w., ouimet, c. & greengard, p. a 38,000-dalton membrane protein (p38) present in synaptic vesicles. proc natl acad sci u s a 82, 4137—4141(1985).
6. mcmahon, h.t. et al. synaptophysin, a major synaptic vesicle protein, is not essential for neurotransmitter release. proceedings of the national academy of sciences 93, 4760—4764(1996).
7. kosmidis, e. et al. regulation of the mammalian-brain v-atpase through ultraslow mode-switching. nature 611, 827—834(2022).
转载本网文章请注明出处