化学学院刘志博团队在《自然》发文报道靶向共价放射性药物
近日,北京大学化学与分子工程学院应用化学系刘志博教授团队于《自然》杂志在线发表了题为“”的研究论文,报道了一类核药物设计领域的颠覆性技术及优异的临床研究数据,有望改写相关疾病的临床诊疗指南。该工作基于现代共价药物分子工程发展了一类新型药物形式,即靶向共价放射性药物(covalent targeted radioligand,ctr),并从分子、细胞、小鼠及患者层面验证了该平台技术的有效性,突破了成纤维细胞活化蛋白(fap,为泛癌种靶点)靶向放射配体因肿瘤摄取、滞留不足导致疗效不佳的瓶颈(图1)。据了解,这是nature杂志自1977年以来首次发表核素治疗相关的工作。
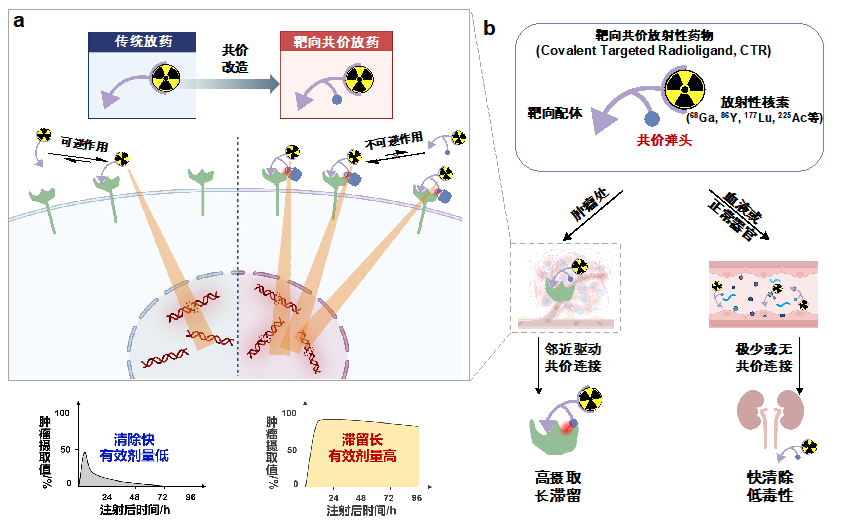
图1 靶向共价放射性药物工作原理及其优势
ctr在体内的工作模式如图1b所示。ctr可以是一个三功能配体,通过在适宜位置和取向上安装基于二代“点击化学”硫(ⅵ)-氟交换反应(sufex)的“潜弹头”(latent warhead),实现配体在不损失亲和力的情况下对靶蛋白的共价连接,从而将携带核素的螯合剂不可逆地修饰到靶蛋白上。当ctr到达肿瘤时,先非共价地结合靶标,后通过邻近效应加速不可逆的共价连接,在加强亲和力的同时将肿瘤清除率降至最低。而其他未结合靶标的自由ctr则被快速排出体内。得益于“潜弹头”的相对生物正交性,ctr的脱靶共价连接有限,因此其系统毒性可被有效控制。值得一提的是,该研究首次报道了在人体中含sufex共价弹头分子的药代动力学研究,并验证了其在放射配体这一新兴药物形式上的匹配性。
1. ctr-fapi不可逆地选择性共价连接fap
对共价弹头的合理应用是ctr成功的关键因素之一。通过对fap口袋残基的分析和共价对接,研究者在小鼠肿瘤模型中的初步研究发现:尽管在现有放射配体fapi-04上安装磺酰氟弹头可提高肿瘤摄取,但存在由于弹头反应活性过高导致的稳定性问题。经弹头筛选,研究者采用放射自显影(autoradioluminography)发现安装间位取代的氟代硫酸脂弹头不仅可在试管中实现超过80%的fap共价结合,且在6天内几乎没有解离。进一步,研究者通过二级质谱分析,发现所设计ctr-fapi分子的共价连接残基位点主要为y210和y450,并通过分子动力学模拟验证了其共价结合构象的合理性和稳定性。
关于共价药物的一个普遍担忧是难以预知的脱靶毒性。由于放射配体普遍具有高亲水性且包含多电荷螯合剂,大多数放射配体对细胞膜的被动渗透性有限,因此ctr对胞内蛋白的脱靶作用可能不是问题。研究人员主要考察了ctr-fapi对fap同源膜蛋白的选择性,发现其仍能保持104倍的高度fap选择性。此外,在小鼠血浆和患者尿液中,ctr-fapi也显示出极低的脱靶反应性。
2. ctr-fapi展现更佳的pet成像对比度
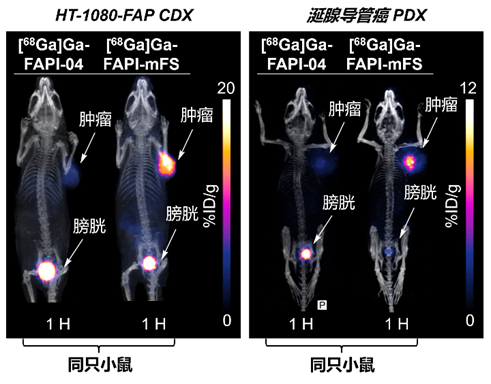
图2 靶向共价放射性药物在动物模型中显示更高的肿瘤摄取
基于一系列分子实验和细胞验证,研究人员分别在fap高表达的细胞来源移植小鼠模型(cell-derived xenograft,cdx)和患者来源移植小鼠模型(patient-derived xenograft,pdx)中进一步验证,发现ga-68(t1/2="67" min)标记的ctr-fapi(即[68ga]ga-fapi-mfs)显示出比原始fapi高2倍以上的肿瘤摄取,而健康组织中的摄取迅速清除(图2)。在一项初步的肿瘤成像临床研究中,这一策略比其他方法(包括传统fapi-pet/ct)识别出了更多的甲状腺髓样癌病灶,并通过手术和病理研究确认了这些病灶为真阳性(图3)。以上结果说明ctr-fapi有潜力成为下一代更高灵敏度的fapi-pet探针。
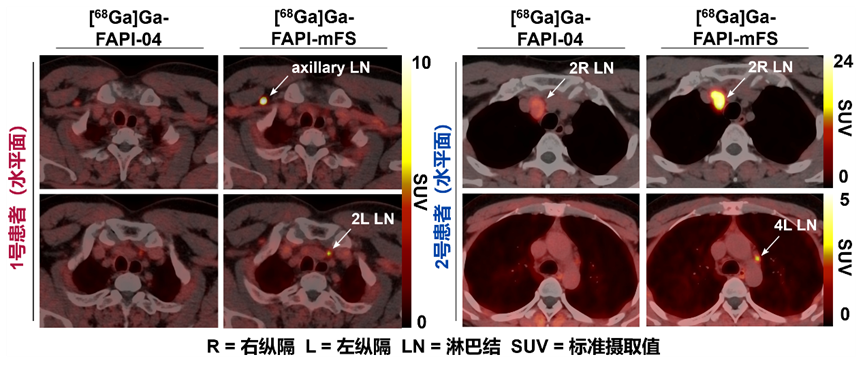
图3 靶向共价放射性药物在癌症病人中灵敏度高,可以发现现有药物难以诊断的肿瘤病灶
3. ctr通过提高滞留增强靶向放射性核素治疗
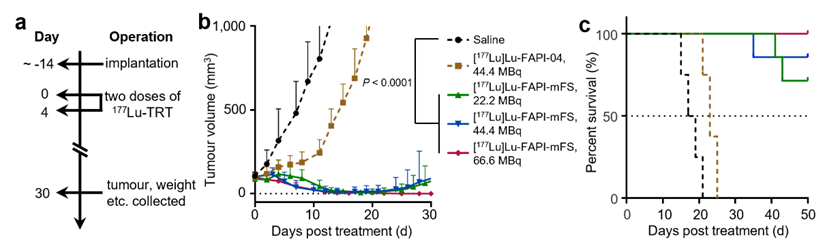
图4 [177lu]ctr-fapi可几乎完全抑制肿瘤生长,并延长小鼠生存期。a、治疗方案;b、肿瘤生长曲线;c、生存曲线
研究者进一步地采用长半衰期的y-86(t1/2="14.7h)正电子核素考察了ctr-fapi的长时间药代动力学,发现肿瘤处摄取的积分下面积(area under curve, auc)增加约10倍。基于lu-177(t1/2="6.7d)标记的ctr-fapi剂量学估算同样说明肿瘤有效剂量提高了10倍左右。最终,研究者分别采用β-(lu-177)和α-放射性核素(ac-225, t1/2="9.9 d)标记ctr-fapi,在后续治疗中几乎完全抑制了小鼠的fap高表达皮下肿瘤生长(图4)。在另一种靶向前列腺特异性膜抗原(psma)的sufex工程化放射配体也显示出更强的治疗效果。由于可连接sufex弹头的蛋白质较为广泛,这一策略或可用于靶向其他靶点的放射性药物,并为调控其他低分子量偶联类药物的药代动力学提供了新途径。
北京大学/昌平实验室的刘志博为该论文通讯作者。昌平实验室崔希洋副研究员(北京大学化学与分子工程学院原博雅博士后)、北京大学肿瘤医院李詝主治医师、国家癌症中心/医科院肿瘤医院孔梓任医师为论文共同第一作者。该研究成果得到国家自然科学基金委、科技部、北京分子科学国家研究中心、北大-清华生命科学联合中心、昌平实验室、北京大学肿瘤医院等机构和项目的资助。该研究还得到了国家癌症中心/医科院肿瘤医院头颈外科刘绍严主任,北京大学肿瘤医院核医学科杨志主任,北京协和医院核医学科霍力主任,北大王初教授课题组,北大分析测试中心周文和刘霞老师,以及北大天然药物与仿生药物国重室王倩老师等的大力支持和帮助。
转载本网文章请注明出处